科研小白学Meta分析📝先搞懂它的类型
下面这段话,医学科研小白们可以仔细看看,特别受用。 非常建议医学科研小白,第一篇SCI就学Meta分析。 因为它相对容易入门,成本低,人人可接触,而且能在短时间内写出来,如果能顺利发表,收获第一篇SCI的速度是很快的!这对刚入门的菜鸟来说,是一个不错的成绩。 并且在写Meta分析的过程中,像文献检索、文献筛选、统计分析、SCI写作等基础科研能力都能锻炼。 很多人刚开始都说我的科研基础差,怎么练呀,那不就是在一次又一次的实战中夯实的吗?Meta分析的难度就非常适合我们拿来练手!!!
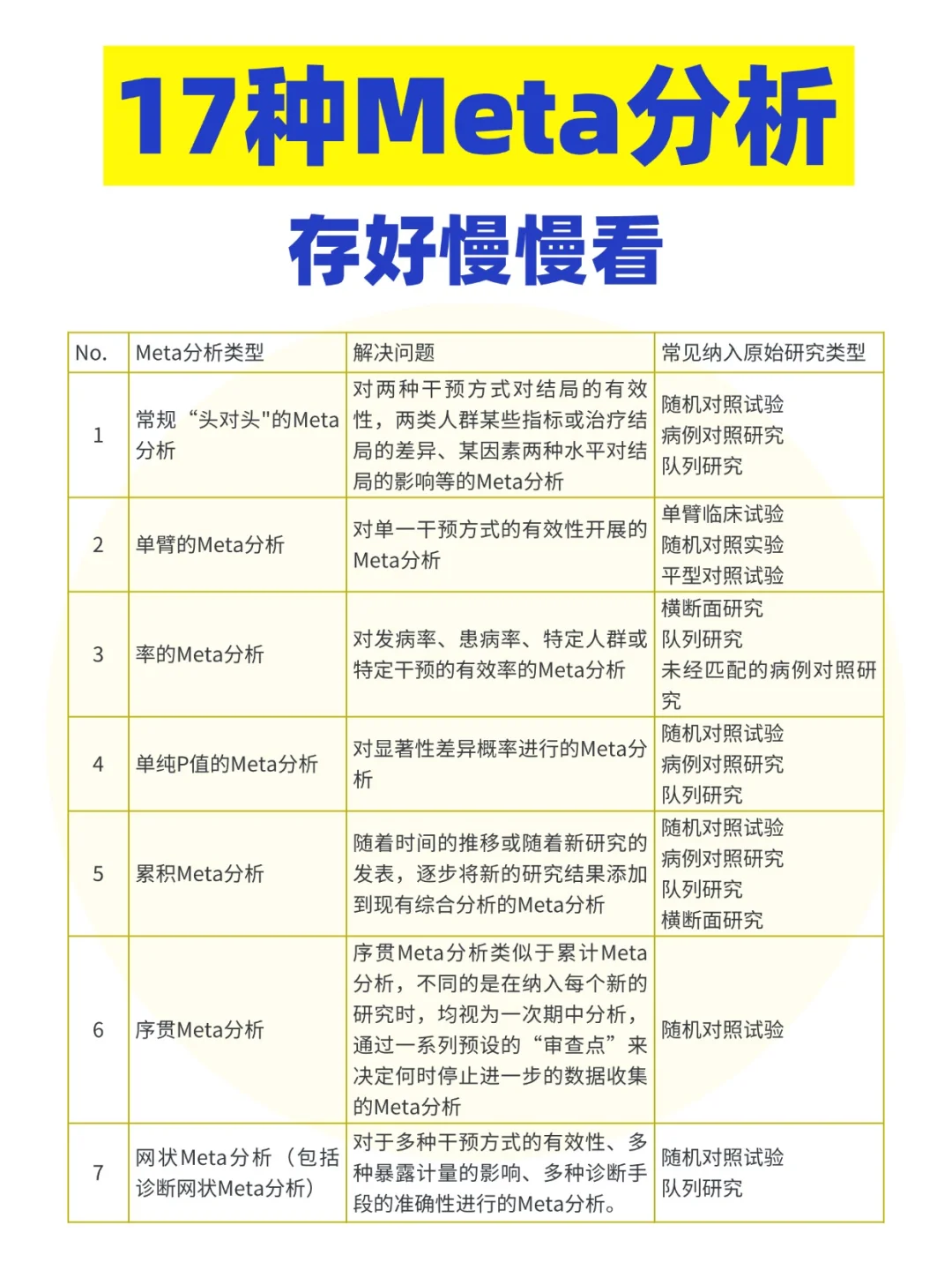
17种Meta分析(存好慢慢看)
| No. | Meta分析类型 | 解决问题 | 常见纳入原始研究类型 |
|---|---|---|---|
| 1 | 常规“头对头”的Meta分析 | 对两种干预方式对结局的有效性、两类人群某些指标或治疗结局的差异,某因素两种水平对结局的影响等的Meta分析 | 随机对照试验、病例对照研究、队列研究 |
| 2 | 单臂的Meta分析 | 对单一干预方式的有效性开展的Meta分析 | 单臂临床试验、随机对照实验、平型对照试验、横断面研究 |
| 3 | 率的Meta分析 | 对发病率、患病率、特定人群中特定干预的有效率的Meta分析 | 未经匹配的病例对照研究 |
| 4 | 单纯P值的Meta分析 | 对显著性差异概率进行的Meta分析 | 随机对照试验、病例对照研究 |
| 5 | 累积Meta分析 | 随着时间推移或新研究的发表,逐步将新的研究结果添加到现有综合分析中的Meta分析 | 随机对照试验、病例对照研究、队列研究、横断面研究 |
| 6 | 序贯Meta分析 | 在纳入每个新研究时,均视为一次期中分析,通过“审查点”决定停止与否的数据收集的Meta分析 | 随机对照试验 |
| 7 | 网络Meta分析(包括诊断性网络Meta分析) | 多种干预方式、多种暴露量影响、多种诊断阶段准确性进行的Meta分析 | 随机对照试验、队列研究 |
| 8 | 诊断性Meta分析 | 对某种诊断方式的准确性进行的Meta分析 | 随机对照试验、队列研究 |
| 9 | 剂量反应关系Meta分析 | 多种剂量与结局事件的关联关系分析(线性或非线性) | 队列研究、随机对照研究、病例对照研究 |
| 10 | 相关系数Meta分析 | 两个指标或干预方式与连续指标/多等级资料的相关性的Meta分析 | 横断面研究、队列研究、病例对照研究、随机对照试验 |
| 11 | 危险因素/影响因素的Meta分析 | 阳性事件的风险因素、相关因素、暴露与阳性事件关系的Meta分析 | 队列研究、病例对照研究、横断面研究 |
| 12 | 机器学习的Meta分析 | 对阳性事件预测或诊断价值的Meta分析 | 基于机器学习的研究(包括队列研究、病例对照研究) |
| 13 | 放射组学的Meta分析 | 放射组学(包括图像深度学习)对阳性事件预测或诊断价值的Meta分析 | 基于放射组学的研究(包括队列研究、病例对照研究) |
| 14 | 交叉设计的RCT | 对随机交叉试验的有效性进行的Meta分析 | 随机交叉试验 |
| 15 | 平状综述 | 已发表Meta分析的系统综述,提供某一主题全面的证据概览 | Meta分析、系统综述 |
| 16 | 个体数据Meta分析 | 从原始作者处获取个体原始数据并进行Meta分析 | 原始数据 |
| 17 | 其他类型(生态相关、全基因组关联研究的Meta分析) | 整合生态学数据或多个GWAS研究数据,探讨生态规律或提高统计功效与重复性 | 生态学研究、GWAS研究 |
1. 常规“头对头”Meta分析
优势:
作为最经典的Meta分析类型,它直接进行两组比较,结论直观易懂,统计方法成熟,是临床指南制定的核心证据来源。尤其适合RCT数据整合,能快速识别优势治疗方案。
挑战:
高度依赖“头对头”直接比较研究,若相关试验数量不足或质量低下(如偏倚风险高),结论可能失真。此外,无法处理多干预比较、多种暴露水平,需依赖网络Meta分析扩展。
2. 单臂Meta分析(Single-Arm Meta-Analysis)
优势:
在缺乏对照组的场景下(如罕见病治疗、突破性疗法早期研究),它能汇总单组数据,快速评估干预的客观缓解率(ORR)或安全性,为后续RCT设计提供预测依据。
3. 率的Meta分析(Meta-Analysis of Proportions)
优势:
专为合并发生率、患病率、特定治疗/特定人群有效率的设计,支持公共卫生政策制定(如疾病负担地图)。通过率转换(如logit变换、双重反正弦变换)减少极端值干扰,结果更稳健。
挑战:
原始研究人群特征差异(如年龄、地域)可能导致高异质性,即使进行亚组分析或Meta回归,仍然很难解释异质性来源。
4. 单纯P值的Meta分析(P-value Combining)
优势:
适用于早期探索性研究,仅需各研究的P值即可快速整合(如Fisher合并检验),成本低、耗时短,适合预研阶段信号筛选。
挑战:
忽略效应量大小与方向,无法评估临床意义。样本量差异大时,结论易偏倚。
5. 累积Meta分析(Cumulative Meta-Analysis)
优势:
按时间顺序动态展示证据累积效应,清晰揭示“结论趋于稳定”的时间节点(如2015年已证实他汀类药物降低心梗风险),避免资源浪费于重复研究。
挑战:
早期低质量研究可能扭曲趋势,需结合敏感性分析剔除高风险研究,但操作复杂。
6. 序贯Meta分析(Sequential Meta-Analysis)
优势:
通过预设信息量阈值(如TSA分析),模拟RCT的“期中分析”,防止因证据不足过早得出假阳性/阴性结论。
挑战:
结果高度依赖预设参数(如α值、期望效应量),若参数设置不合理(如过于乐观估计效应量),可能错误终止分析。
7. 网状Meta分析(Network Meta-Analysis, NMA)
优势:
突破“头对头”限制,同时比较多种干预措施、不同暴露水平、诊断方式,生成疗效排名,尤其适合临床多选项决策。
挑战:
需满足“一致性假设”(直接与间接证据一致),若网络存在闭合环不一致(如A vs. B与A vs. C vs. B矛盾),模型可能崩溃。在复杂的网状分析中,计算量较大,特别是诊断网状Meta分析。此外,各种干预方式的文献量过少时会严重影响证据等级。
8. 诊断性Meta分析(Diagnostic Meta-Analysis)
优势:
双变量模型可同时合并敏感性与特异性,减少阈值效应干扰(如不同CT值界定肺癌),生成量化诊断性能。
挑战:
异质性来源复杂(如设备型号、操作者经验),亚组分析常需原始数据支持,但多数研究未提供。
9. 剂量反应关系Meta分析
优势:
揭示剂量/暴露与结局的非线性关系(如维生素D补充与骨折风险的“U型曲线”),指导个体化治疗(如确定最低有效剂量)。
挑战:
依赖原始研究的剂量分层数据,若多数研究仅报告单一剂量(如“高 vs. 低”),模型拟合困难,结论可靠性低。