截图为证:这位姐妹就是Meta分析的神!!
一次性讲清楚Meta分析
前言:
如果没有临床数据,又没有实验条件,真心建议医学生们试试Meta分析,先把毕业问题解决(如果学校明确规定Meta分析不能用于毕业,再考虑其他发文类型)科研小白也非常适合Meta分析练手,因为它比较容易学,而且学完整个流程后,文献检索、文献筛选、统计分析、SCI写作等基本科研技能,你都能练习到。这些通用的科研基础没有专门的课程去教,都是在实践中自己锤炼出来的!
Meta分析是什么?
官方版解释
Meta分析(Meta-analysis)是一种系统性的统计方法,旨在整合多个独立研究的结果,通过定量分析得出更精确、可靠的总体效应估计。其核心原理是通过合并不同研究的数据,克服单一研究样本量小、结论偶然性高的局限性,从而增强统计检验效能,评估研究间的一致性,并探索异质性来源。Meta分析不仅需要严格的文献检索和质量评估,还需选择合适的统计模型(如固定效应模型或随机效应模型),以综合效应值并解释结果的意义。
根据国际权威定义(如Cochrane协作组),Meta分析需遵循标准化流程:
确定研究问题:
明确研究目标,采用PICOS框架(人群、干预、对照、结局、研究设计)定义纳入标准。
系统检索文献:
覆盖多数据库(如PubMed、CNKI),避免发表偏倚,确保查全率与查准率。
质量评估:
使用工具(如Cochrane偏倚风险评估)量化研究质量,排除低质量数据。
数据合成与分析:
通过异质性检验(如Q检验、I²统计量)选择模型,计算合并效应值,并通过亚组分析、敏感性分析验证结果稳健性。
其应用领域涵盖医学、教育学、社会科学等,尤其在循证医学中用于评估药物疗效、诊断试验准确性及政策制定等。
通俗易懂版
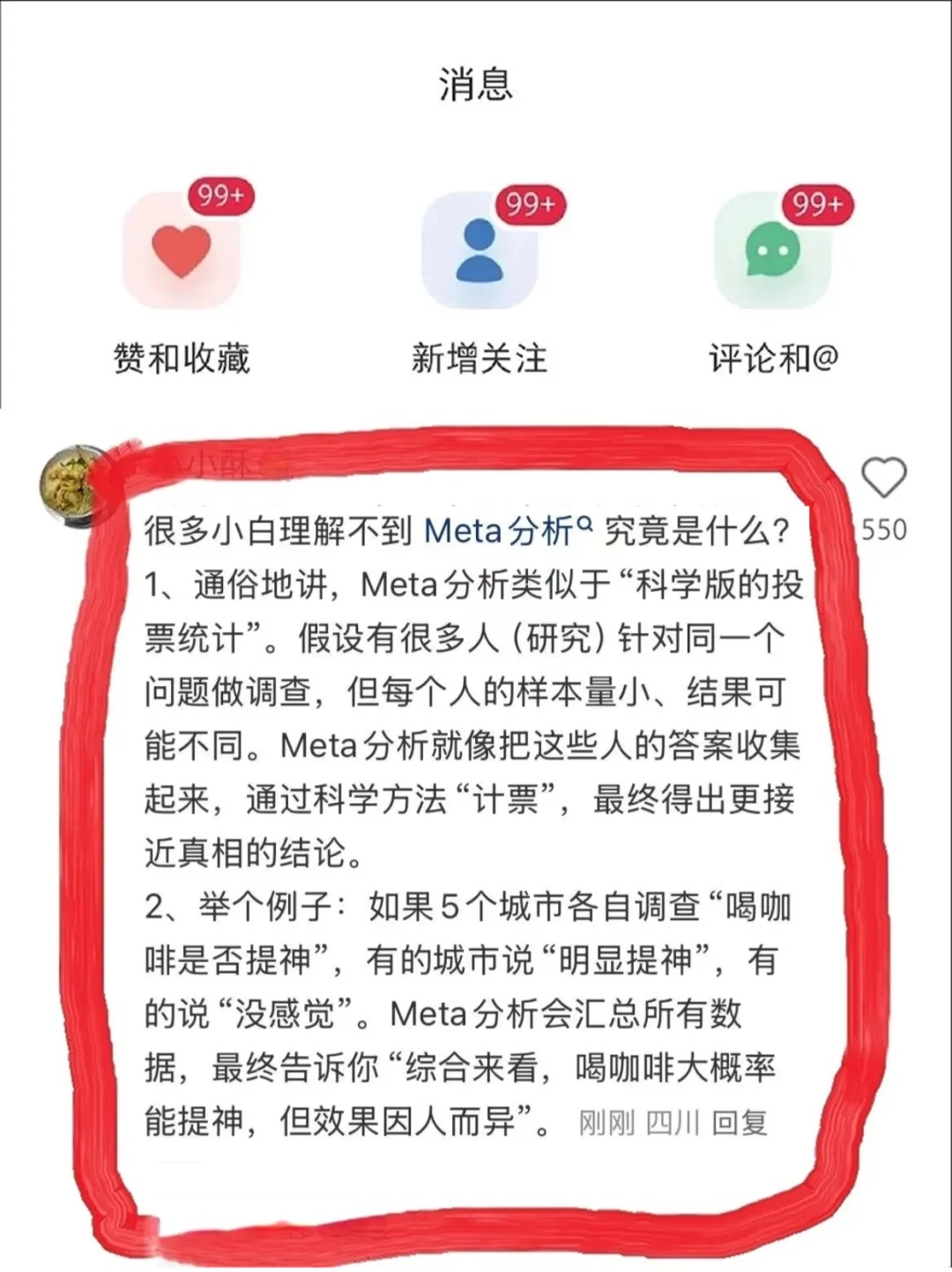
Meta分析类似于“科学版的投票统计”。假设有很多人(研究)针对同一个问题做调查,但每个人的样本量小,结果可能不同。Meta分析就像把这些人的答案收集起来,通过科学方法“计票”,最终得出更接近真相的结论。
具体来说:
- ✅ 收集选票: 找到所有相关研究,无论结果是否“受欢迎”(比如阴性结果也要纳入)。
- ✅ 筛选有效票: 剔除设计不合理或数据不可靠的“废票”(低质量研究)。
- ✅ 统计结果: 用数学方法计算“多数人的意见”,比如10个研究中有7个显示某方法有效,Meta分析会告诉“综合来看,有效的可能性是70%”。
- ✅ 检查争议: 分析不同研究的分歧点,比如某些研究结果差异太大,可能是人群不同或方法问题,需要进一步解释。
举个例子:
如果5个城市各自调查“喝咖啡是否提神”,有的城市说“明显提神”,有的说“没感觉”。Meta分析会汇总所有数据,最终告诉你“综合来看,喝咖啡大概率能提神,但效果因人而异”。
所以说,Meta分析既是严谨的“数据裁判”,也是化解争议、寻找共识的“科学桥梁”。因此在医学科研中,Meta分析提供着不可替代的价值。
✅ 解决“小样本困境”,提升结论可信度
医学研究常受限于样本量小(如罕见病研究或单中心试验),单一研究可能因统计效能不足导致结果不稳定(如假阴性/假阳性)。
Meta分析的作用:
将多个独立研究的数据合并,形成“大样本池”,显著提高统计检验效能。
例如:某药物对罕见病的疗效若在10项小规模研究中显示微弱效果,Meta分析可通过合并数据验证其是否具有统计学意义。
✅ 化解研究间矛盾,揭示真相
同一医学问题(如某种疗法的有效性)的不同研究常因设计、人群、地域等差异导致结论冲突。
Meta分析的作用:
通过异质性分析(如I²值)量化研究间差异,判断结论冲突是源于偶然还是本质区别。
例如:新冠疫苗的有效性在不同国家研究中存在差异,Meta分析可探索是否与病毒毒株变异、接种人群年龄分布有关。
✅ 支持循证医学决策,减少主观偏差
医学实践需基于最佳证据,但医生或政策制定者可能因个人经验或片面文献检索产生偏倚。
Meta分析的作用:
通过系统性检索和严格质量评估,提供“全景式证据地图”,避免选择性引用。
例如:临床指南推荐某治疗方案时,需依赖Meta分析综合全球高质量随机对照试验(RCT)的结果,而非单一权威专家的观点。
✅ 挖掘隐藏规律,推动新假说
Meta分析不仅能回答预设问题,还能通过亚组分析、回归分析发现新关联。
例如:某降糖药的Meta分析可能意外发现其对心血管疾病的保护作用,从而催生新的研究方向。通过剂量-效应分析,明确药物最佳使用剂量范围。
✅ 标准化证据评估,增强透明性
Meta分析要求遵循PRISMA声明等国际标准,确保流程透明、可重复。
关键环节:
- 文献检索策略公开(避免遗漏关键研究)
- 偏倚风险评估(如Cochrane工具)
- 数据共享与敏感性分析(验证结果稳健性)
这些标准化步骤使其成为医学领域公认的“金标准证据合成方法”。
✅ 应对复杂医学问题的“多维分析”能力
医学问题常涉及多因素交互(如基因、环境、治疗手段),Meta分析可通过多种统计模型处理复杂数据。
例如:
- 网状Meta分析:比较多种干预措施的间接效果(如A药 vs. B药 vs. C药)
- 个体患者数据Meta分析(IPD-MA):整合原始数据,探索患者亚组(如特定基因型人群)的疗效差异
📚 经典案例:Meta分析改变医学实践
他汀类药物与心血管疾病:
早期小规模研究对其效果存在争议,Meta分析综合了17万例数据,明确了他汀可降低心血管事件风险20%-30%,成为全球用药指南的核心依据。
抗抑郁药有效性争议:
Meta分析发现部分药物对轻度抑郁无效,促使临床治疗策略调整。
🔍 总结:Meta分析不可替代的核心原因
| 传统研究局限 | Meta分析的突破 |
|---|---|
| 单研究样本量小,结论不稳妥 | 合并数据提升统计效力,结论更稳健 |
| 研究间矛盾无法解决 | 量化异质性,揭示差异来源 |
| 证据碎片化,决策主观化 | 系统整合证据,支持客观决策 |
| 资源浪费难以累积 | 明确知识缺口,指引未来研究方向 |
随着医学数据爆炸式增长(如真实世界数据、组学数据),Meta分析将进一步结合机器学习、因果推断等方法,成为转化医学和精准医学的核心工具。其“证据桥梁”角色不仅不会减弱,反而因数据复杂性而更加重要。